塔菲爾方程
外觀
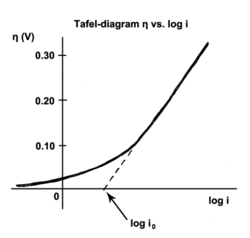
塔菲爾方程給出了電極反應的反應速率和過電位的關係[1]。塔菲爾方程最早是由瑞士化學家尤利烏斯·塔菲爾根據實驗數據歸納得出。
單電極的塔菲爾方程可以寫作:
式中
概述[編輯]
交換電流密度指的是氧化劑或還原劑和電極之間達到電子轉移平衡時的電流密度,代表著兩者平衡時的電化學反應速率。塔菲爾斜率可以通過實驗求出,也可以通過理論推導。
定義為
式中
另一形式[編輯]
塔菲爾方程還可以寫作
式中
應用[編輯]
塔菲爾方程可以應用於極化率高的區域,對於低極化率區域,電流和極化率常呈線性關係:
參見[編輯]
參考文獻[編輯]
- ^ Bard, A. J.; Faulkner, L. R. 「Electrochemical Methods. Fundamentals and Applications」 2nd Ed. Wiley, New York. 2001. ISBN 0-471-04372-9
- G.T. Burstein. A Century of Tafel’s Equation: 1905–2005 A Commemorative Issue of Corrosion Science. Corrosion Science. 2005, 47 (12): 2858–2870. doi:10.1016/j.corsci.2005.07.002.



















